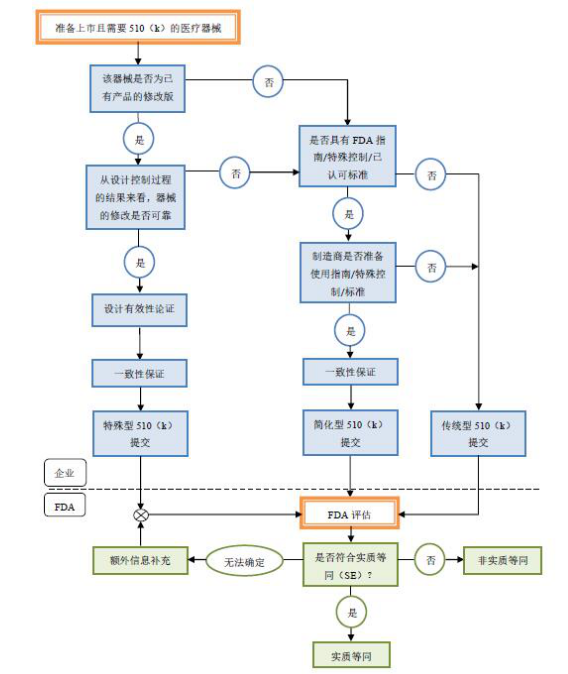
一.510(K)产品注册途径是指:按照美国联邦食品、药品和化妆品法案510(K)条款的规定,对申请上市的医疗器械是否与上市的参照器械实质性等同(substantially equivalent)做出判断,从而决定其能否上市的流程。
二.三种不同类型的510(K)
1)传统的
2)特殊的
3)简短的(Abbreviated 510(K))
三.实质性等同(substantially equivalent)
FD&C ACT之中 有明确说明 FDA对实质等同性SE的判断基准是申请上市器械与参照器械:
1)预期用途、技术特征完全相同(指材料、设计、能源或其他特征),或者预期用途相同,技术特征不同,且不同点已在510(K)申请材料中说明、该不同点不影响产品的安全性和有效性、有证据表明申请产品在安全性和有效性上至少与参照器械相当